با واکسن های کرونای ایرانی آشنا شوید
اقتصاد۲۴- همراه با تداوم چرخه انتقال و مرگومیر ناشی از کووید-۱۹ در جهان، روند تولید و توزیع انواع واکسنهای مختلف علیه کووید-۱۹ در کشورهای مختلف ادامه دارد. هماکنون بیش از ۲۰۰ واکسن در جهان در مراحل مختلف توسعه و ارزیابی میباشند. آخرین وضعیت واکسنهای این بیماری در دنیا تا تاریخ ۴ خرداد ۱۴۰۰ در شکل شماره ۱ نشان دادهشده است.
شکل شماره ۱: وضعیت واکسنهای کووید-۱۹ تا تاریخ ۴ خرداد ۱۴۰۰ در دنیا.
واکسنهای دارای مجوز اضطراری در دنیا:
واکسنهایی که تاکنون در دنیا تایید شده و مجوز اضطراری گرفتهاند، در جدول شماره ۱ نشان دادهشده است.
جدول ۱. واکسنهای تایید شده و دارای مجوز اضطراری کووید- ۱۹ در دنیا تا تاریخ ۴ خرداد
|
ردیف |
نام واکسن |
نوع واکسن |
کشور سازنده |
کشورهای مصرفکننده |
تأییدیه |
درصد کارایی |
|
|
1 |
فایزر–بیوانتک |
Pfizer/ BioNTech BNT162b2 |
RNA |
انگلیس |
81 کشور |
دارای مجوز FDA مجوز مصرف اضطراری در دنیا |
91.3 درصد |
|
2 |
مُدرنا |
Moderna |
RNA |
آمریکا |
44 کشور |
دارای مجوز FDA
|
بیش از 90 درصد |
|
3 |
آسترازنکا |
Oxford/AstraZeneca |
Non Replicationg Viral Vector |
انگلیس |
83 کشور ازجمله ایران |
مجوز مصرف اضطراری در دنیا آمادگی دریافت مجوز FDA |
76 درصد |
|
4 |
جانسون و جانسون |
Janssen (Johnson & Johnson) Ad26.COV2.S |
Non Replicationg Viral Vector |
آمریکا |
37 کشور |
دارای مجوز FDA مجوز اضطراری در نقاط مختلف دنیا |
72 درصد(ایالاتمتحده) 68 درصد(برزیل) 64درصد(آفریقای جنوبی) |
|
5 |
اسپوتنیک وی |
Gamaleya Sputnik V |
Non Replicationg Viral Vector |
روسیه |
59 کشور از جمله ایران |
مجوز اضطراری در نقاط مختلف دنیا |
91.6 درصد |
|
6 |
بهارات بیوتک |
Bharat Biotech Covaxin |
Inactivated |
هند |
هند، ایران، نپال، زیمباوه و موریتیوس |
مجوز اضطراری در نقاط مختلف دنیا |
78 درصد |
|
7 |
سینوفارم |
Sinopharm (Beijing) BBIBP-CorV |
Inactivated |
چین |
30 کشور از جمله ایران |
تایید شده در چین مجوز اضطراری در دنیا |
78.1 درصد |
|
8 |
سینوواک |
Sinovac CoronaVac |
Inactivated |
چین |
20 کشور |
مجوز اضطراری در نقاط مختلف دنیا |
50.65 درصد(برزیل) 91.25 درصد (ترکیه) |
|
9 |
کانسینو |
CanSino Ad5-nCoV |
Non Replicationg Viral Vector |
چین |
چین، مجارستان، مکزیک و پاکستان |
(تایید شده در چین) مجوز اضطراری در نقاط مختلف دنیا |
65.28 درصد |
|
10 |
ای پی واک کرونا |
FBRI(BEKTOP) EpiVacCorona |
Protein Subunit |
روسیه |
روسیه و ترکمنستان |
تایید شده در ترکمنستان |
نامعلوم |
|
11 |
سینوفارم (ووهان) |
Sinopharm (Wuhan) Inactivated (Vector Cells) |
Inactivated |
چین |
2 کشور چین و امارات |
تایید شده در چین استفاده محدود در امارات |
72.51 درصد |
|
12 |
- |
Anhui Zhifei Longcom RBD-Dimer |
Protein Subunit |
چین |
چین و ازبکستان |
مجوز اضطراری در چین |
نامعلوم |
|
13 |
- |
Research Institute for Biological Safety Problems RIBSP |
Inactivated |
قزاقستان |
قزاقستان |
مجوز اضطراری در قزاقستان |
نامعلوم |
|
14 |
- |
Shenzhen Kangtai Biological Products BIOKANGTAI |
Adenovirus |
چین |
چین |
مجوز اضطراری در چین |
نامعلوم |
توضیح: البته ۳ شرکت: Imperial College London، MERCK (دو واکسن) و THE UNIVERSITY OF QUEENLAND درزمینهٔ تولید واکسن فعالیت داشتند که با شکست مواجه شدند.
مروری بر واکسنهای کووید-۱۹ ایران که وارد فاز بالینی شدهاند
ایران واکسیناسیون علیه کووید-۱۹ را با واکسنهای وارداتی اسپوتنیک وی، آسترازنکا/آکسفورد، سینوفارم و کووکسین (بهارات) آغاز کرده است. تا تاریخ ۴ خرداد، ۱۴ تقاضای فعال (در حال انجام) جهت ساخت واکسن کووید-۱۹ به سازمان غذا و داروی کشور ارایه شده است که از بین آنها، ۵ واکسن موفق به اخذ کد اخلاق جهت مرحله بالینی شدند.
|
فاز مطالعه |
نوع واکسن |
|
فاز 3 بزرگسالان |
واکسن مشترک موسسه انستیتو پاستور و موسسه فینلای کوبا (واکسن سوبرانا) |
|
فاز 3 در افراد بالای 18 سال |
واکسن موسسه شفافارمد (واکسن کووبرکت) |
|
فاز 2 بزرگسالان |
واکسن موسسه تحقیقات واکسن و سرمسازی رازی (واکسن کووپارس) |
|
فاز 2 بزرگسالان |
واکسن موسسه میلاد دارو نور (واکسن فخراواک) |
|
فاز 2 بزرگسالان |
واکسن ساخت شرکت تحقیقاتی و تولیدی سیناژن (واکسن سیناژن) |
در ادامه مطالب، ویژگیهای اساسی این پنج واکسن آمده است
واکسن مشترک موسسه انستیتو پاستور و موسسه فینلای کوبا (واکسن سوبرانا)
انستیتو پاستور ایران از شروع پاندمی کرونا، موضوع تولید واکسن مشترک با کشور کوبا را آغاز کرد. این واکسن حاوی پروتئین نوترکیب از ناحیه RBD ژنوم ویروس Sars-COV-۲ با رژیم ۲ نوبته (با و بدون دوز بوستر) است؛ که بعد از گذراندن موفق فاز ۱ و ۲، وارد فاز سوم کارآزمایی بالینی شده است. مرحله سوم کارآزمایی این واکسن تصادفی شده با گروه پلاسبو و دو سوکور در ۲۴ هزار جمعیت ایرانی ۱۸ تا ۸۰ سال در کشور و ۴۴ هزار نفر در کوبا در حال انجام است.
بیشتر بخوانید: ورود ۱۰۰ هزار دز واکسن روسی به تهران
فاز سوم این واکسن در ۷ استان کشور (اصفهان، بابل، زنجان، هرمزگان، مازندران، کرمان، همدان و یزد) بهطور تصادفی در دو گروه در حال اجرا است.
گروه اول: گروه دریافتکننده واکسن (۸۰ درصد افراد موردمطالعه)
گروه دوم: گروه پلاسبو یا ادجوانت (۲۰ درصد افراد موردمطالعه بهعنوان شاهد)
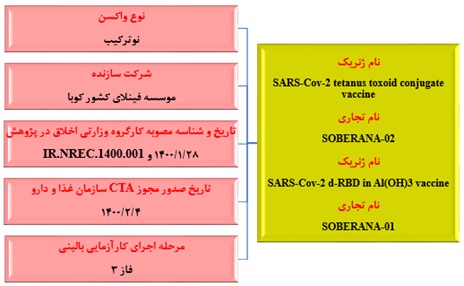
شکل شماره ۲. مشخصات واکسن مشترک موسسه انستیتو پاستور و موسسه فینلای کوبا (واکسن سوبرانا)
واکسن موسسه شفا فارمد (واکسن کووبرکت): فاز ۳ در افراد بالای ۱۸ سال
واکسن کووبرکت نخستین واکسن کووید-۱۹ تولید محققان ایرانی است که موفق به دریافت کد اخلاق و کارآزمایی انسانی از وزارت بهداشت شده است. این واکسن در شرکت شفا فارمد وابسته به بنیاد برکت ستاد اجرایی فرمان امام (ره) تولیدشده است که اکنون در مرحله فاز کارآزمایی قرار دارد. این واکسن از نوع ویروس غیرفعال شده است که کارآزمایی بالینی دو سو کور آن با کنترل پلاسبو فاز ۱ جهت بررسی بیخطری و ایمونوژنیسیتی واکسن در جمعیت سالم و افراد ۵۱ تا ۷۵ ساله انجامشده است.
فاز ۲ و ۳ این واکسن با طراحی کارآزمایی تصادفی، دو سو کور و موازی با گروه کنترل پلاسبو در جمعیت ۱۸ تا ۷۵ ساله در حال انجام است.
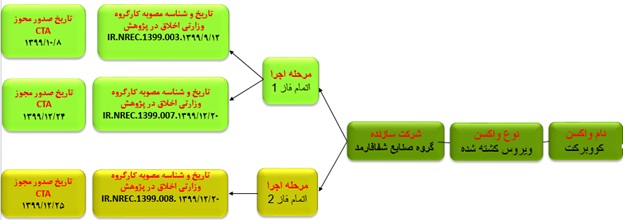
شکل شماره ۳. مشخصات واکسن موسسه شفا فارمد (واکسن کووبرکت)
واکسن موسسه تحقیقات واکسن و سرمسازی رازی (واکسن کووپارس): فاز ۲ بزرگسالان
واکسن کووید-۱۹ کووپارس، توسط موسسه تحقیقات واکسن و سرمسازی رازی بر پایه پروتئین نوترکیب اسپایک SARS COV-۲ ساخته و از دو بخش آنتیژن و ادجوانت در سه دوز (تزریقی- استنشاقی، دو دوز اول واکسن بهصورت عضلانی و دوز سوم بهصورت استنشاقی در روز ۵۱ به داوطلبان تزریق میشود) تولید خواهد شد.
شروع واکسیناسیون با واکسن" کووپارس" در ۵۰۰ موش و ۲۵ میمون سبز آفریقایی در مدت یک سال انجام و در ادامه پس از ارسال CTD به سازمان غذا و دارو و دریافت تأییدیههای کمیته اخلاق فاز یک و دو کارآزمایی بالینی ادامه پیدا کرد. فاز یک کارآزمایی بالینی در اسفندماه ۱۳۹۹ آغاز و نیمه فروردینماه با ۱۳۳ جمعیت بزرگسال سالم ۱۸ تا ۵۵ ساله در مطالعهی کارآزمایی بالینی با طراحی موازی، ۴ گروه شامل ادجوانت بهتنهایی و واکسن در دوزهای ۵، ۱۰ و ۲۰ میکروگرم در ۲۰۰ میکرو لیتر به پایان رسید.
فاز دوم کارآزمایی بالینی با حضور ۵۰۰ داوطلب از جمعیت ۱۸ تا ۷۰ ساله در حال انجام است؛ که در این مطالعه کارآزمایی بالینی با طراحی موازی و دوسوکور، ۲ گروه واکسن و دارونما حضور دارند که انتظار بر این است تا پایان تیرماه ادامه داشته باشد.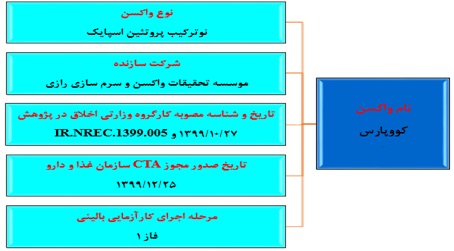
شکل شماره ۴. مشخصات واکسن موسسه تحقیقات واکسن و سرمسازی رازی (واکسن کووپارس)
واکسن موسسه میلاد دارو نور (واکسن فخراواک): فاز ۲ بزرگسالان
واکسن فخراواک "واکسن شهید فخری زاده یا سپند"، واکسنی از نوع ویروس غیرفعال شده است که اسفندماه ۱۳۹۹ موفق به دریافت مصوبه اخلاق در پژوهش از سازمان غذا و دارو شده است؛ واکسنی دو دوزی که تحت مطالعه کارآزمایی بالینی دوسوکور با کنترل پلاسبو موردمطالعه قرار میگیرد. این واکسن محصول شرکت «میلاد دارو نور» در زیرمجموعه وزارت دفاع و پشتیبانی نیروهای مسلح است.
مطالعه فاز یک این واکسن، بررسی بیخطری، ایمنیزایی و انتخاب دوز مناسب واکسن غیرفعال شده کووید-۱۹ (MIVAC) در گروههای واکسن در دو دوز (TCID۵۰) در حال انجام است. این مطالعه در جمعیت سالم بزرگسال ۵۵-۱۸ ساله بهصورت کارآزمایی بالینی تصادفی شده، دوسو کور با کنترل پلاسبو در حال انجام میباشد و فاصلههای دو دوز نیز تقریباً ۲ و ۳ هفته در نظر گرفتهشده است.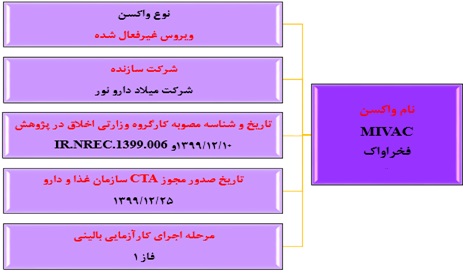
شکل شماره ۵. مشخصات واکسن موسسه میلاد دارو نور (واکسن فخراواک)
واکسن ساخت شرکت تحقیقاتی و تولیدی سیناژن (واکسن سیناژن)
واکسن سیناژن، پنجمین واکسن کووید-۱۹ در ایران است که مجوز کد اخلاق را گرفته است. این واکسن اولین واکسن کرونای ساخت بخش خصوصی در ایران است که به آزمایش بالینی رسیده است و مشترک با کشور استرالیا تولید خواهد شد. درواقع ابتدا توسط یک شرکت استرالیایی به نام "وکسین" که تخصص آن در تحقیقات واکسن است توسعه پیداکرده است و بعد فاز ۱ را با موفقیت بر روی ۴۰ شهروند استرالیایی گذرانده است و اکنون بعد از طی آزمایشات حیوانی و فاز ۱ وارد فاز ۲ خواهد شد. کارآزمایی بالینی فاز دو این واکسن، تصادفی شده، دو سو کور و حاوی واکسن نما جهت بررسی ایمنی و اثربخشی واکسن نوترکیب با پروتئین اسپایک ویروس SARS-COV-۲ (اسپایکوژن) میباشد که در دو دوز ۲۵ میکروگرم به فاصله ۲۱ روز تزریق خواهد شد (مطالعه از اوایل خرداد ما شروع خواهد شد).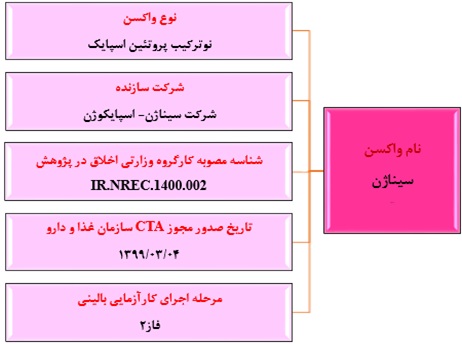
شکل شماره ۶. واکسن ساخت شرکت تحقیقاتی و تولیدی سیناژن (واکسن سیناژن)
افق پیش روی واکسنها:
خوشبختانه به نظر میرسد ویروس کرونا، واکسن پذیر است. سابقه مطالعات قبلی بر روی سایر ویروسهای این خانواده برای تهیه واکسن و سرمایهگذاریهای کلان توسط کشورها و سازمانهای مختلف بینالمللی به کنترل این باندمی از طریق ساخت واکسن کمک کرد. برآورد میشود تا پایان سال ۲۰۲۱، بین ۸ تا ۲۱ میلیارد دوز واکسن در دنیا تولید شود. افق کشورهای ثروتمند و پیشرفته حصول به ایمنی جمعی با واکسیناسیون قبل از شروع تابستان و یا حداکثر تا ابتدای پاییز است و پیشبینی میشود که تا پایان سال ۲۰۲۱ واکسیناسیون خود را به اتمام برسانند. باید توجه داشت که کشورهایی که فقط به سبد COVAX متکی هستند، نمیتوانند انتظار واکسیناسیون بیش از ۲۰ ٪ از جمعیت خود را داشته باشند؛ بنابراین سرمایه گزاری برای تولید و استفاده از واکسنهای داخلی در هر کشوری میتواند یک اولویت مهم و اساسی در مبارزه با این پاندمی باشد.
در صورت موفقیت واکسنهای تولیدی، ایران ضمن دستیابی به تکنولوژی ساخت و کسب دانش برای تولید این واکسن، میتواند با تکیه به واکسنهای تولید داخل کشور زودتر از بعضی از کشورهای دنیا به پوشش لازم واکسیناسیون علیه کووید-۱۹ و احتمال برگشت به زندگی عادی برسد.
نتیجهگیری:
اقدام دانشمندان و شرکتهای دارویی و واکسنسازی ایران برای ساخت واکسن کووید-۱۹ اقدام بهجا و مناسبی است. اگر تولید واکسنهای ملی با موفقیت و در موعد مقرر به نتیجه برسد، ایران میتواند زودتر از بسیاری از کشورهای دیگر دنیا پوشش واکسیناسیون خود را کامل کند. بااینحال برای کاهش آسیبهای این بیماری باید کماکان و تا زمان دستیابی به واکسنهای ساخت کشور، ورود واکسن بهسرعت و جدیت دنبال شود. بهخصوص سرعت در انجام واکسیناسیون گروههای در معرض خطر با واکسنهای در دسترس در سریعترین زمان ممکن از آسیبهای این بیماری در کشور میکاهد. پیشنهاد میشود برای جلب اعتماد علمی و عمومی، هرچه سریعتر نتایج مطالعات فاز ۱ و ۲ و در صورت امکان، فاز ۳ مطالعات داخلی چاپ گردد.
منبع: کمیته ساماندهی تحقیقات کووید-۱۹، معاونت تحقیقات وزارت بهداشت، درمان و آموزش پزشکی
































